原文作者:Elliot Hershberg
编译:LlamaC
正文?
十年前,科学论派信徒(不是科学家)鲍勃·杜根将他创立的美国生物技术初创公司以 210 亿美元(没错,不是百万)的价格卖给了艾伯维。他的公司 Pharmacyclics 研发出一款极具前景的抗癌药物,并因此获得了丰厚回报。实际上,据报道,杜根超过 35 亿美元的收益是历史上公开收购案例中回报最为丰厚的之一。
除了创始人杜根的特立独行——以及其他几位大人物参与其中,使整个事件足以载入史册——这原本是一笔相对普通的交易。一家大型制药公司因其一款重磅产品的专利独占期即将结束,正面临寻找新收入来源的巨大压力。而一家美国初创公司的突破性药物恰好填补了这一空缺。
生物技术产业的很大一部分正是建立在这种动态之上。小型初创企业已成为创新的主要来源,每年承担着大部分早期临床试验。大型制药公司则以丰厚溢价收购这些初创企业,持续补充其产品管线。
但情况正在发生变化。十年后,杜根卷土重来。这一次,他带来了一种在临床试验中击败默克公司年收入 300 亿美元的癌症免疫治疗药物 Keytruda 的新药。关键在于,杜根并非在美国实验室发现此药,而是从一家中国公司获得了授权。
与 Pharmacyclics 不同,这个故事并未以数十亿美元的天价收购告终。相反,默克公司转向同一来源,以 5 亿美元从另一家中国公司购得了同类型药物的自有版本。
这意义重大。正如我们最近在人工智能领域所见,中国已成为生物科技领域不可小觑的竞争威胁,展现出快速开发能与美国实验室产品匹敌——甚至超越——的新药能力。换言之,“制药业正迎来其‘ deepseek 时刻 ’。”
再举一个例子。随着 GLP-1 类药物取得爆炸性成功,制药公司竞相获取自己下一代此类产品,以与诺和诺德和礼来争夺市场份额。默克再次将目光投向中国,以 1.12 亿美元预付款收购了一款口服 GLP-1 药物。该交易还包含基于商业成功的后续里程碑付款,总额达 19 亿美元。
作为背景,美国生物制药公司 Viking Therapeutics 在其研发管线中拥有一款口服 GLP-1/GIP 激动剂,目前市值 38 亿美元。与其全面收购 Viking,为何不从中国低价获取一个分子,看看它是否有效呢?
在生物技术市场低迷的时刻,加剧的外部竞争使情况更加艰难。虽然并购市场已经放缓,但现在创始人和投资者都因为那些他们从未听说过的隐秘中国竞争对手在最后一刻搅黄交易而夜不能寐。
整个局势引发了大量分析。迄今为止,我最欣赏的有美籍华人生物科技初创公司创始人 David Li 的反思、他在 Timmerman Report 中的后续分析、彭博社的报道,以及 Alex Telford 对“我们所有的药物都会来自中国吗?”这一问题深思熟虑的见解。
在这里,我想退一步思考我们是如何走到这一步的。
1987 年,默克公司因"押注神奇分子"登上《财富》杂志封面,被评为"美国最受尊敬企业"。
在此之前几十年,默克公司的科学家们负责研发了针对高血压的突破性分子、历史上一些最成功的疫苗(史上最高产的疫苗学家之一莫里斯·希勒曼曾是默克的科学家)、首批他汀类药物以及全新类别的抗生素。
如今,对于市场上最热门的两款产品,默克公司并未依赖美国生物技术初创企业生态系统(该体系在 1987 年仍处于艰难起步阶段),而是从中国生态系统中获取分子——直到最近,中国才成为创新的重要来源地。
显然,全球药物研发行业已经经历了显著的演变。在此关头,我认为有必要思考药物研发技术商品化的漫长历程,以及这一历史模式对行业未来的影响。
药物研发技术商品化的漫长历程
让我们来思考一下生物制剂。
在历史长河中,绝大多数药物都是人类偶然发现的、对人体生理有积极影响的植物性化学物质。随着时间推移,人们开发出工具,能更系统地筛选化学空间以寻找有用的小分子。另一小类则是诸如胰岛素等可从动物体内分离并用于治疗疾病的蛋白质。
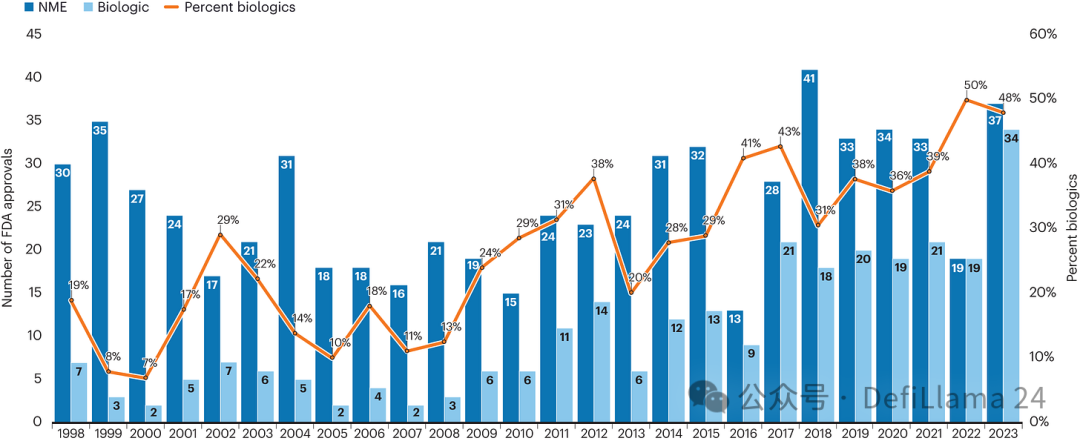
1976 年基因泰克的成立源于重组 DNA 技术的革命性突破,这一变革播下了彻底改变的种子。借助基因工程工具,人们得以以全新方式生产生物源性分子来缓解疾病。五十年后,每年获批的生物制剂数量已几乎与小分子药物持平。
但最初,很少有人相信这种新型药物会成为可能。而且,全世界具备尝试所需必要技能的人也同样寥寥无几。人们很容易忽略一个事实:基因泰克最初只是一个边缘项目,科学家们日夜工作,穿着统一的 T 恤、牛仔裤和跑鞋。
正如彼得·蒂尔所言,这家公司掌握着一个重要的共同秘密,而外界尚未理解。
成功改变了这一切。当基因泰克取得首个产品突破时,市场以狂热的乐观态度回应。没有什么——甚至戴安娜王妃——比改造生命更令人兴奋。
1980 年基因泰克上市时,初始股价为 35 美元。交易开始仅一小时,股价便飙升至 88 美元,几乎翻了三倍。当时的场面简直是一片狂热。
到 1983 年,美国公司已向新兴生物技术企业投资了 5 亿美元。两年后,美国商务部估计约有 200 家生物技术公司总共吸引了近 20 亿美元的投资。
回首往事,这显然是一个炒作泡沫。重组 DNA 技术当时仍处于起步阶段。像重组胰岛素这样的重大突破并未迅速接踵而至。监管问题依然悬而未决。大规模生产生物制剂也是一项挑战。
最初的繁荣过后是一段幻灭与收缩的时期。1985 年,马萨诸塞州的一位记者写道:
如果这一切对几乎没有或完全没有商业记录的科学家来说显得太过遥远,那么你是对的。仅此一点,在后繁荣时代的生物技术产业中,两种趋势已占据主导地位。
首先,在少数资本较为雄厚的公司中,科学家/创始人/首席执行官们正在聘用,或被迫聘用传统的“数字专家”担任公司总裁或首席运营官。这些是来自大公司的经验丰富的商业高管,而非学术界的学者。位于剑桥的 BioTechnica International 刚刚聘请了一位在杜邦公司工作 20 年的资深人士。在邻近列克星敦的 Collaborative Research,新任总裁曾领导强生的一家子公司。位于尼德姆高地的 Damon Biotech 的新总裁也是如此。
其次,行业势头似乎已转向有利于大公司。尤其是那些通过股权购买和研发合同为生物技术初创企业提供大量原始资金的公司。从某种意义上说,新生物技术公司首次公开募股的良好反应,只是推迟了许多公司的坏消息。如今,当这些年轻公司急需新一轮资金注入时,杜邦、格雷斯公司、孟山都和礼来等公司却将投资转向内部生物技术能力。因此,行业专家预测将出现一波并购潮。EF Hutton 分析师尼尔森·施耐德认为,多达三分之二的生物技术公司要么合并,要么被大型制药或化工制造商收购。
换句话说,该行业被迫走向成熟并真正实现收入,现有组织也醒悟过来,开始内部构建自身的生物技术能力。到 20 世纪 80 年代末,大多数生物技术股票已损失了四分之三的价值。
但在这一泡沫的核心,有一个重要的真理内核:重组 DNA 技术确实是制造新药物的革命性工具。即便在更为冷静的环境中,那些拥有资源、技术、人才和毅力得以生存的公司,仍在不断推出新产品。
在合成胰岛素之后,基因泰克在整个 80 年代和 90 年代又生产了七种生物制剂。安进公司是另一家成立于 1980 年的早期生物制剂先驱,他们凭借一系列突破性药物在激烈的竞争中脱颖而出。再生元公司成立于 1988 年,在最初的繁荣之后,他们通过对人类基因组的深入研究及强大的单克隆抗体生产技术平台逐渐确立了自身特色——单克隆抗体被证明是最重要的生物制剂类型之一。
尽管仍有许多怀疑者,生物制品的应用范围仍在医学领域持续扩大,到 2022 年其获批数量首次与小分子药物持平。(我们之前看到的图表。)
这些先行者的商业成功同样不可否认。基因泰克于 2009 年被罗氏以 468 亿美元收购,至今仍作为极具影响力的独立子公司运营。安进目前市值达 1680 亿美元。再生元现估值 780 亿美元,股价较首次公开募股时上涨近 4000%。2
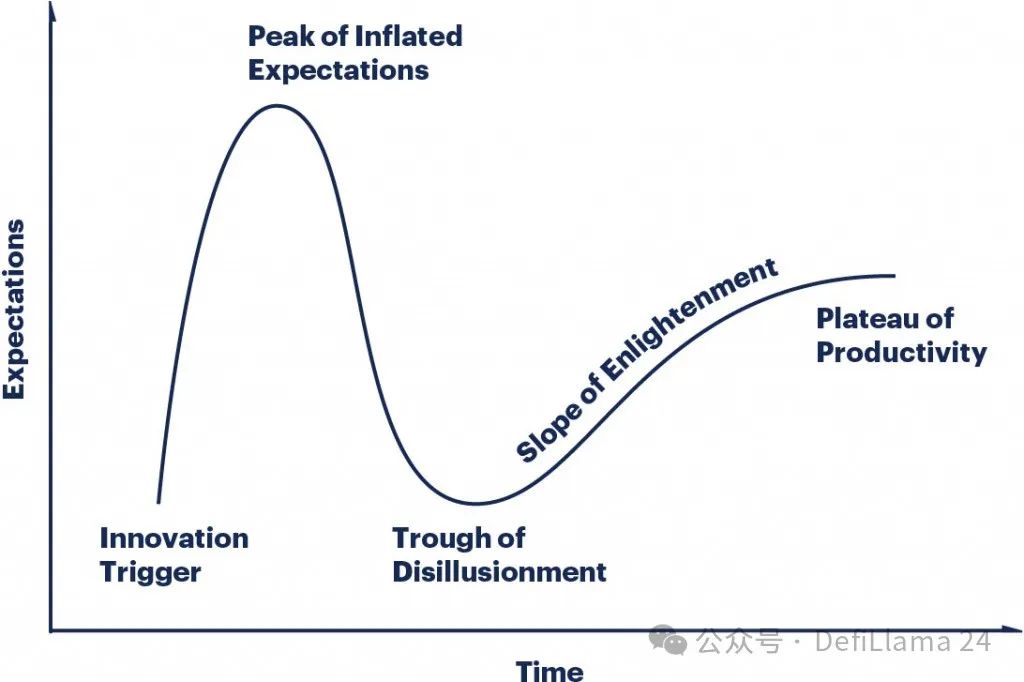
这一演变过程几乎是 Gartner 炒作周期的教科书式范例。最初的"创新触发点"引发了一轮巨大的炒作和兴奋浪潮。当炒作未能立即兑现时,市场便趋于冷静。若初始触发点确有实质内容,随着时间的推移会出现更为渐进式的回升。
我们似乎确实已经进入了一个“生产力高原”。生产生物制剂的能力不再是少数公司严守的秘密。全球科学家们已经花费数十年时间完善开发这些药物的工具。一大批公司如雨后春笋般涌现,提供抗体开发服务。
以 Adimab 为例。该公司成立于 2007 年,利用新一代抗体工程技术——即酵母表面展示技术——为众多合作伙伴快速生产新分子。目前,他们已与超过一百家不同伙伴合作,“源自我们平台的临床项目超过 75 个”。
源:Adimab
鉴于 Adimab 是一家私营公司,很难将其商业成功与安进或再生元等先行者进行直接比较。但从十年前一笔二级交易中 11 亿美元的估值推算,其大致已成长为约 50 至 100 亿美元规模的企业。
如今,若企业希望采用不同技术,或在成本、速度、地理位置乃至其他多种因素上有特定偏好,他们可以选择与 FairJourney Biologics(2024 年估值约 9 亿美元)、OmniAb(市值约 4 亿美元)、Ablexis、Specifica、Creative Biolabs、Twist Biosciences、Alloy Therapeutics 或其他公司合作。此列表仅为示例,远未穷尽所有选项。
值得注意的是,每一代企业的规模大约下降一个数量级。先行者成长为约 1000 亿美元以上的公司,随后崛起的领先服务提供商成为约 100 亿美元以上的企业,而如今发现市场的新进入者则是约 10 亿美元以上的公司。
在我看来,这就像是教科书上对商品化的定义,即逐步将商品或服务转化为大宗商品并在价格上展开竞争的过程。大宗商品指的是可以与其他同类商品互换的商品或服务。
想想电子产品。最初,只有少数几家公司能生产出最好的电视,这些公司因此收取高额溢价。随着时间的推移,这种溢价被竞争消磨殆尽。如今,众多公司在好市多以数百美元的价格销售配备智能功能的大尺寸平板屏幕。这就是商品化的过程。
同样,抗体发现服务提供商之间的差异越来越难以区分,许多公司使用相似的技术针对相同的药物靶点生产抗体。
到目前为止,我们只关注了抗体的历史。但我想请你和我一起大胆假设,这可能会惹恼一些药物开发者:没有任何发现技术能免受商品化这一不可避免趋势的影响——就像几乎所有其他技术一样。
对于大小分子而言,一旦发现技术——无论是高通量筛选、计算机模拟筛选、体外或体内模型,还是分析检测——实现标准化,全球各地的公司将竞相将其作为服务提供。
这是模态商品化的漫长历程。
随着时间的推移,革命性的理念成为下一波创新的普遍基石。
生物技术的战略演进
在发现技术标准化和商品化的同时,生物技术投资也走向专业化。经过数十年的精进,该行业趋向于采用标准化的公司估值模型,并涌现出新的策略。
一种已获得广泛认可的策略是“快速跟随者”方法,即开发一种新药,使其在已有药物针对的靶点上成为“同类最佳”,而非针对全新药物靶点成为“首创”。
2003 年发表的一项分析指出了“追求最佳”的两大关键优势。首先,这类药物显然具有更低的风险特征,因为其靶点已通过基于人体证据的药物审批得到验证。投资者通常会讨论他们为新靶点假设所承担的“生物学风险”程度。其次,风险差异似乎并未获得相应的回报。事实上,观察 1991 年至 2000 年间推出的药物,大多数重磅炸弹药物都是针对已知靶点开发的,而快速跟进者创造的价值高于风险更高的创新药物。
追求最佳
默克公司收购我们之前研究过的口服 GLP-1 激动剂,就是这一策略的鲜明例证。诺和诺德与礼来公司在验证首批 GLP-1 药物疗效时承担了巨大风险。如今,其他公司正竞相开发具有改良特性的快速跟进产品,例如以药丸形式替代注射给药。
许多生物科技投资者已将此类分析推向了逻辑的极致。随着早期融资轮次规模及其背后资金的膨胀,将大量资本押注于完全未经证实的靶点假说上愈发难以自圆其说。实践中,这导致已验证靶点领域出现了严重的扎堆现象。
药物研发管线中的聚集现象
为了让事情更加高效,2010 年代左右兴起了“虚拟生物技术公司”,它们将所有研发工作外包给像 Adimab 这样的发现合作伙伴。其目标通常是快速开发出针对已知靶点的最佳分子,然后将其出售给大型制药公司进行后期开发和商业化。
这段行业历史对于理解近期中国许可协议的激增至关重要,因为许多顶级外包合作伙伴都是中国的合同研究组织(CROs)。
药明生物,这家提供全方位生物制剂发现与制造服务的中国巨头企业,已跃居全球第二大外包合作伙伴,占据了超过 10%的全球市场份额。
如今,中国在 2015 年新政策中体现出的极具逻辑性的战略演变,是从单纯的服务提供商转向自主研发药物。在多数人使用标准化发现技术针对相同药物靶点的世界里,中国拥有两大关键优势:
速度。新的一系列改革使得临床试验能够更快地启动。
中国创新药物研发趋势(再次感谢 Alex Telford 的精彩博文让我注意到这一数据!)
成本。中国科学家的薪资仅为美国科学家的一小部分。一支由高技能——通常受过美国培训——研究人员组成的大军可以投入到更多问题的研究中。
凭借这些优势,中国的初创企业和生物制药公司似乎已覆盖了已知药物靶点的领域。企业以临床前或早期资产的形式,对广泛靶点布局廉价的“看涨期权”。当某一特定靶点或产品构想获得大型制药公司青睐时,这些“期权”便可通过加大投入加速现有项目进程来执行。
这给快速跟随策略带来了巨大压力。当美国科学家夜晚入睡时,地球另一端竞争对手实验室里的机器仍在嗡嗡作响。
迄今为止,我们已经追溯了药物发现技术商品化的历史以及随之而来的生物科技投资专业化。这些变化有助于为行业的“DeepSeek 时刻”提供背景。
现在,让我们思考未来价值可能积累的领域。
人工智能可能是最后一波商品化浪潮
过去几年,大量资金涌入那些怀揣雄心壮志、旨在利用人工智能变革药物研发的公司。像 Xaira Therapeutics 这样以 10 亿美元“种子”资金起步的企业,目标是自主研发药物。但 EvolutionaryScale、Profluent、Chai Discovery 和 Latent Labs 等许多公司则更倾向于采取类似 Adimab 的策略,将这项新技术作为广泛赋能的基础设施来提供。
当 Latent Labs 成立时,Pillar 的 Tony Kulesa 写道:
由此诞生了一个清晰的愿景:在药物发现领域普及先进人工智能工具的使用。尽管每家寻找治疗分子的生物技术和制药公司都明白人工智能的作用,但大多数公司并不具备开发自己前沿模型和工具的能力。西蒙的洞见在于,通过让合作伙伴即时获取最佳工具,Latent Labs 能够加速整个行业的药物设计进程。
大规模融资与新商业模式的结合引发了既好奇又怀疑的复杂反应。Endpoints 的 Andy Dunn 写道:“Latent 的成立展示了以 AI 为核心的初创企业如何能在生物科技领域打破传统。大多数生物科技公司围绕某个分子、研究论文或关键知识产权成立,而 Latent 的投资者则押注于 Kohl 和另一位前 DeepMind 开发者、AlphaFold 的 Alex Bridgland 的 AI 才能,相信他们能找到出路。”
让我们考虑这项投资论点的熊市情况和牛市情况。
在熊市情况下,与商品化技术相比,无论是专注于新数据生成、模型扩展、架构改进,还是这三者的某种组合,这些技术方向都无法显著推动进展。
在麻省理工学院分子机器学习会议的现场笔记中,Dimension 的西蒙·巴尼特写道:“我对[Adimab 联合创始人]威特鲁普博士演讲的理解是,他认为单克隆抗体(mAb)发现基本上是一个已解决的问题,而机器学习(ML)对这一领域的影响被夸大了。”
如果人工智能技术最终仅对抗体发现等问题产生微小的量化影响,提供这些解决方案的公司可能会加入众多竞争提供此类服务的公司行列。我们可能会看到市值低于 10 亿美元的公司,而非约 500 亿至 1000 亿美元以上的世代巨头。
牛市的情况如何?跟我一起眯起眼睛想象一下,AI 的进步轨迹将带来质的飞跃,真正引领我们进入一个设计而非发现的世界。想象一个模型,它能零样本预测出柏拉图式抗体——对任何靶标都具有完美的亲和力和特异性,在每一个维度上都经过极致优化。输入目标产品特性(TPP),就能得到一款药物。
那可能会是件大事。
一个常被引用的比较对象是 Cadence Design Systems,这家市值 660 亿美元的公司大部分收入来自向半导体行业授权其电子设计自动化(EDA)软件和知识产权。在高价值领域,最佳设计工具可能极具价值。那么,“制药业的 Cadence”是否会规模更大?
有证据支持这一技术发展轨迹吗?
去年三月,华盛顿大学的贝克实验室发表了一篇题为《原子精度从头设计单域抗体》的预印本论文。基于数十年来在计算蛋白质设计领域的领先工作,他们引入了一个 AI 模型,能够有效为特定靶标生成微型抗体(称为 VHHs 或纳米抗体)。
图 2 部分内容:原子精度从头设计单域抗体。结合剂以粉色显示,目标蛋白为青绿色。指定的表位(即抗体结合的区域)以橙色显示。
这些结果激起了巨大的兴奋和兴趣——包括为启动 Xaira 投入的 10 亿美元赌注。但这项工作只是一个概念验证,而非能吐出完美抗体的神奇黑匣子。科学家们指出,所生成的纳米抗体对其靶标的亲和力仍然太弱,无法成为药物。而且纳米抗体是一种奇怪的蛋白质,与人类抗体并不完全相似——这再次限制了它们在许多临床应用中的效用。
不到一年后,Baker 实验室“显著更新”了他们最初的预印本,将其更名为《使用 RFdiffusion 进行原子级精确的抗体从头设计》。 正如你可能猜到的,标题之所以更改,是因为研究范围已扩展至 VHH 设计之外。更新后的预印本还展示了单链可变片段(scFvs)的设计,这是另一种抗体形式,拥有两个可变域,而非 VHH 的单一可变域。
另一个重要更新是针对亲和力问题的回应。作者写道:“虽然初始计算设计显示的亲和力一般,但利用 OrthoRep 进行亲和力成熟可以生产出保持预定表位选择性的个位数纳摩尔级结合物。”换言之,人工智能目前尚不能生成完美的结合物,但可以通过现有实验技术快速调整优化。
所以这大约是一年的时间。冒着在两个数据点之间划线的风险,进展似乎相当迅速。展望未来,如果有人利用 OrthoRep 创建了一个庞大的亲和力训练数据集,而这一步脱离了原子的领域,以改进模型权重的形式编码在比特的世界中,那会怎样?
未来五年,是什么会阻碍从 VHHs 到 scFvs 再到成熟单克隆抗体的持续发展?
再次粗略观察,我们似乎正处在生物制剂开发数字化的边缘。如果速度、成本——可能还有质量——方面的优势足够显著,这可能导致发现市场的整合,新进入者迅速吸引大量外包工作份额,取代现有企业。
现在让我们认真思考一下“基础模型”这一概念下的世界会是什么样子。如果生物结构和功能的重要基础模式是通过众多任务学习而来的呢?正如 Latent Labs 的 Simon Kohl 对 Endpoints 所说:“这一愿景更为宏大。我认为我们可以在此基础上扩展,随着时间的推移,我们会发现分子相互作用层面之外的许多其他领域也能通过生成模型来引导。”
因此,如果这一点——或我刚才概述的任何部分——属实,其中一些公司可能会变得非常庞大。
但最大的威胁之一很可能是……商品化!毕竟,整个“deepseek时刻”的框架源于中国研究团队在资源少于美国同行的情况下,AI 能力突然实现飞跃。
已有迹象表明这一点。
迄今为止,诺贝尔蛋白质结构预测奖的共同获得者、DeepMind 和 Isomorphic Labs 的首席执行官德米斯·哈萨比斯一直押注于算法创新,而非构建专有数据护城河来确保模型防御性。在最近的一次采访中,他表示:“让你的算法更好,让你的模型更优。你确实拥有足够的数据——只要你在算法方面足够创新。”
令人惊讶的是,严肃的算法竞争者如此迅速地涌现。
2024 年 5 月,Isomorphic 与 DeepMind 发表论文,介绍了其最新且最先进的结构预测模型 AlphaFold3。同年 9 月,Chai Discovery 发布并开源了一款尖端模型。约两个月后,麻省理工学院的一个研究小组又推出了性能相当的另一开源版本。
在这场新的人工智能竞赛中,价值将如何积累值得关注。
无论如何,所有这些进展都将为药物研发和其他环节的创新开辟新机遇。
发现平台可能变得更具价值
并非所有生物技术平台都专注于治疗模式。一些公司关注的是硬币的另一面:识别新的生物靶点以开发药物。在史蒂夫·霍尔茨曼的“平台公司类型学”中,这些被称为“洞察平台”。
关于生物技术平台战略
专注于疾病洞察也伴随着一系列战略挑战。Holtzman 在其原始帖子中写道:
然而,2 类 A 型平台公司面临着一系列 1 类平台公司未曾遇到的挑战。这些挑战本质上源于 2 类 A 型平台公司的产出是数据/信息/洞察,而非如 1 类平台公司那样生产新化学实体(NCEs)和生物治疗药物。
- 生物制药行业的数据历史就是其商品化的历史。
- 以药品/产品为"生命线"的公司有着既得利益,将数据"预竞争化"(或至少在独占一段时间后这样做)。他们凭借产品取胜;不愿被信息所有者所束缚。
- 知识产权(IP)环境日趋严格:过去仅凭展示某基因在病变组织中过度表达(或疾病状态下的基因突变)的转录谱,就能获得“通过任何方式调节靶点 A 以治疗疾病 X 的方法”这类逻辑形式的专利授权(附带权利要求说明“方式”可以是抗体、反义核酸、RNA 干扰、基因治疗、小分子等)的日子已一去不复返。
- 此外,随着时间的推移,客户群体的需求变得更加广泛。在 20 世纪 90 年代,大多数大型制药公司的客户愿意接受将数据使用限制在小分子药物发现和开发上的条款(因为这是他们唯一从事的领域),而如今,所有制药公司/大型生物技术公司都会要求获得利用这些数据进行所有治疗模式开发的权利。
- 最后,Genus 2, Species A 平台公司在数据的生成、管理和分析方面拥有并构建了其专业知识。它并不具备或无法承担在一个或多个治疗模式中药物发现/开发的重大能力投资,或在一个或多个疾病领域的深入生物学/转化能力培养。
- 最终结果:Genus 2, Species A 平台公司放弃其数据/信息业务,转而建立并成为一家药物发现与开发企业。
让我们分解一下。
首先,重要的是要认识到数据生成技术本身也经历了一个漫长的商品化过程。(这就是技术,各位!)其次,过去的主要问题在于与大型合作伙伴的不对称谈判——他们曾独占发现技术,这使他们在针对新靶点实际创造化学物质时拥有不公平的优势。
这种动态已经开始转变。CRO 行业的成长和成熟已经使得洞察公司能够带着自己的新化学实体(NCEs)而非仅仅是围绕目标洞察的专利参与合作伙伴讨论。
如果人工智能加速了这一动态会怎样?随着时间的推移,随着模式变得越来越商品化,从目标洞察到可开发化学物质的时间和成本可能会进一步压缩。
在这个世界秩序中,天平可能发生倾斜。针对已知靶点的新疾病见解,其价值可能超越化学空间中任何渐进式的起点。
毕竟,GLP-1 药物超过 1000 亿美元的成功故事建立在生物学洞见之上,而非技术模式的进步。
有几个经济和技术现实可能会减缓这方面的进展。
在经济层面,正如 David Yang 精辟指出的那样,GLP-1 之所以成为制药业的成功案例而非生物科技公司的胜利,部分原因在于并购在该行业的核心地位。大多数早期生物科技投资者都寄望于通过大型收购实现资金流动,这意味着他们密切关注制药巨头的收购清单。而制药买家确实不愿斥资数十亿美元去验证新的生物学假设——尤其是在市场机遇规模尚不明朗的情况下。
我们如何改变这一现状,释放出更具创新性药物的新浪潮?我们需要继续缩短从发现、开发到商业化的每个环节的时间和成本。
这样做将使早期药物发现变得更有价值。
提升发现和商业化能力看似都是技术问题。加速发展可能需要新技术和监管改革。借鉴中国的经验(这次换一换思路!)并研究其近期的改革举措,或许能为后者提供一个良好的起点。
在技术层面上,重要的是要认识到,模拟人类生物学比模拟特定模式是一个更为困难的 AI 问题。考虑两个问题:我的抗体是否以更高的亲和力结合这个靶点?激活 GLP-1 受体会对整个人体生理产生什么影响?实验室中明确回答第一个问题的工具已经具备。而第二个问题的答案只有在首次人体试验后才能完全知晓,因为我们的临床前模型只是对人类生物学的粗略近似。
更有效地模拟人类生物学可能需要大量数据生成和在新人工智能范式上的持续进展。
随着时间的推移,应对这些经济和技术挑战可能会极大地重塑生物制药行业的格局,引领一波新兴商业生物技术公司推进大胆新疗法的浪潮。
但从长远来看,所有这些快速叠加的技术也可能导致与传统生物技术商业模式更为彻底的背离。
护城河可能大不相同
在大多数行业中,存在多种可行策略以建立持久的竞争优势。Hamilton Helmer 提出的经典 7 Powers 框架旨在列举最普遍采用的方法。
7 大力量分别是:
- 规模经济——随着产量增加,单位成本下降的企业。
- 网络经济——一种随着用户基础扩大,客户实现的价值也随之增加的商业模式。
- 逆向定位——企业采用一种新的、更优越的商业模式,而现有企业由于担心现有业务被蚕食而无法效仿。
- 转换成本 —— 一种商业模式,客户预期因转向替代方案而遭受的损失大于所获得的价值。
- 品牌效应——由于历史信息的影响,一个企业在提供客观上相同的产品或服务时,享有更高的感知价值。
- 受困资源——一家企业拥有对某种令人垂涎的资源的优先获取权,这种资源能独立提升价值。
- 流程力量——一个企业的组织结构和活动组合能够实现更低的成本和/或更优质的产品,这些优势只有通过长期投入才能匹敌。
冒着过于简化的风险,在生物制药领域,只有两种力量真正重要。大型制药公司受益于规模经济,因为它们能够通过现有产品组合的收入分摊开发和商业化的成本。而对于生物技术公司来说,基本上唯一真正的力量来源是以新知识产权(IP)形式控制的垄断资源。
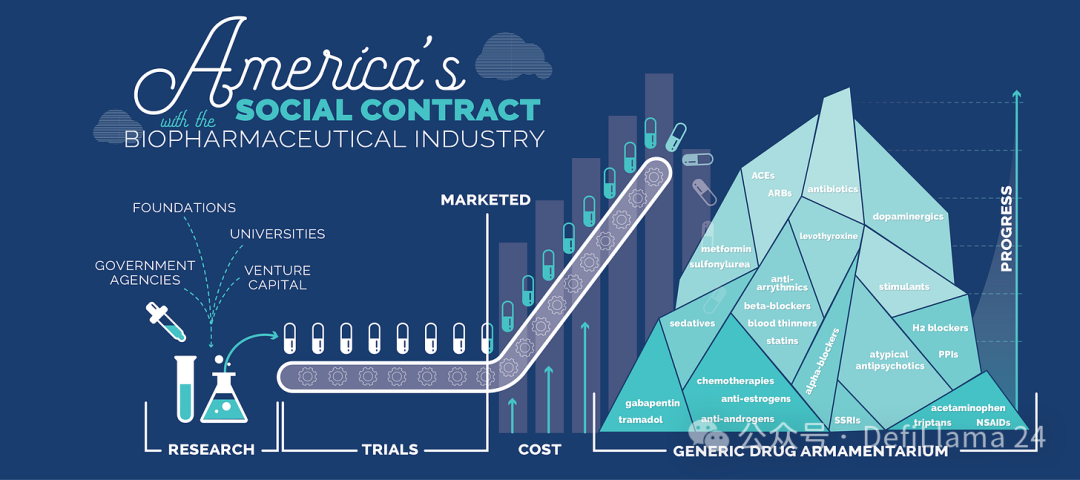
正如彼得·德鲁克曾写道:“制药业是一个信息产业。”小分子药物的价值与其物理形态无关,后者几乎不值钱。能够对任何现有实体产品收取最高利润,纯粹是知识产权的功能。一旦知识产权到期,仿制药制造商就能迅速介入,提供大幅降低的价格。
这就是 RA Capital 的彼得·科尔钦斯基所定义的“生物技术社会契约”。科学家和企业家因创新而获得专利独占权的奖励。但这种独占权是有限的。一旦到期,创新药物就将成为后世子孙都能负担的廉价商品。
来源:美国与生物制药行业的社会契约
商品化带来的隐忧是,这可能很快成为中国与生物制药行业之间的社会契约——只要他们能以更低成本、更快速度生产出同等知识产权的产品。
但如果有一种不同的方式在生物技术领域建立防御壁垒呢?
有一些早期例子指向了防御性的正交形式。对于 CAR-T 疗法——一种以改造患者自身细胞来消灭癌症为核心的新型医学形式——其通用化将呈现何种面貌尚难预料。在科尔钦斯基关于《生物技术社会契约》的书中,他实际上对此表示了担忧。销售这些药物的公司可能从工艺力量而非围绕知识产权的垄断资源中获得护城河。
现在让我们随着时间的推移向前推进。
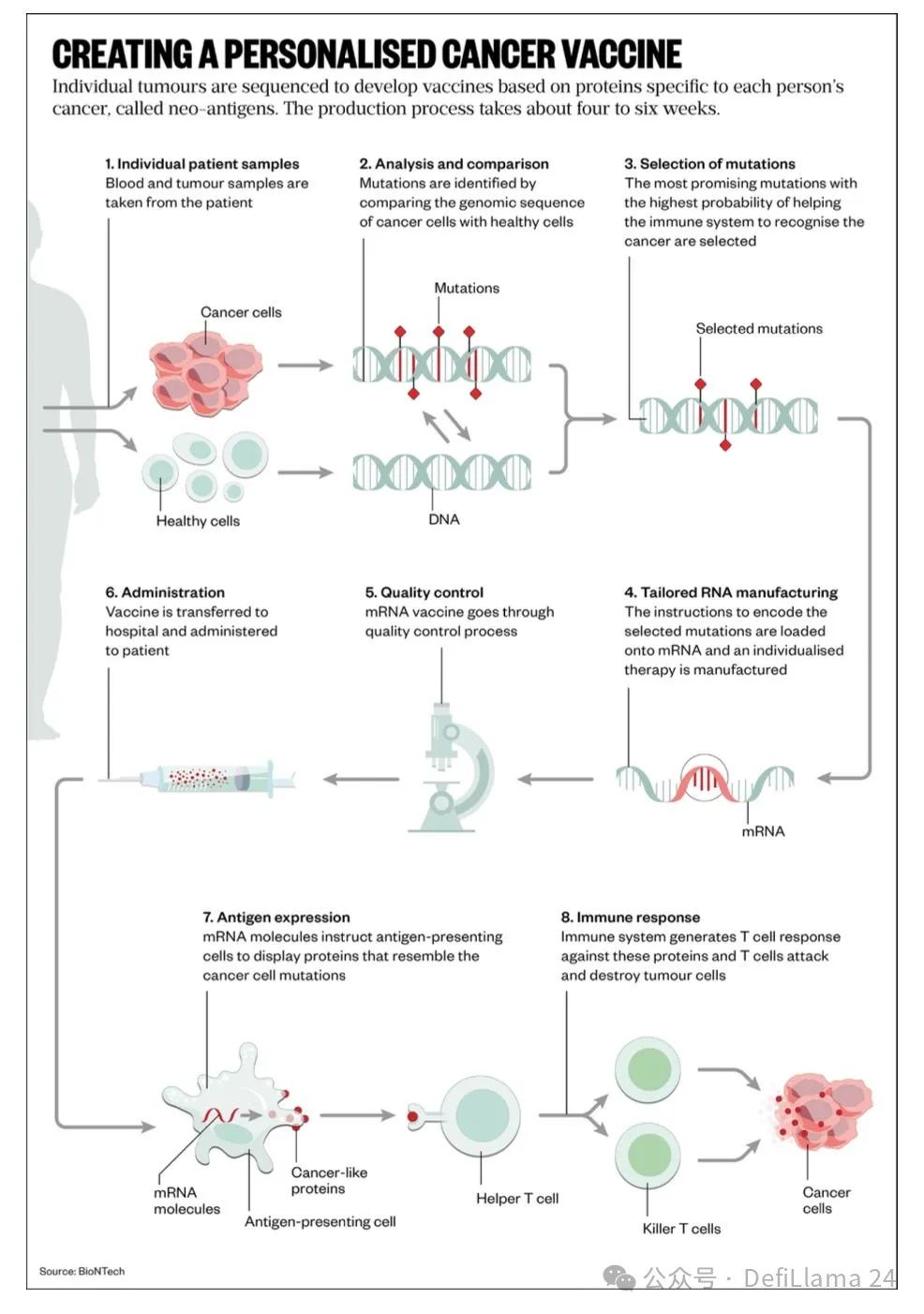
个性化癌症疫苗是另一种具有此类形态的治疗方法。这类药物的核心并非单一的化学成分构成。相反,每一剂都是通过患者测量数据、算法和生产步骤的复杂组合而制成。
这带来了非常有趣的后果。这可能是第一种具有网络经济效应的药物。由于每一剂药物都是通过算法设计的,随着收集的数据增多,其质量可以得到提升。患者可以从拥有最大数据壁垒的公司生产的药物中获益。这种方法显然也受益于流程力量。随着时间的推移,作为市场领导者,这种新模式的赢家甚至可能积累起明显的品牌优势。
如果更多形式的药物开始呈现这种趋势,我们可能会看到一波生物技术公司直接竞争,试图将自己确立为全新一代的制药公司。
想到这里,我不禁想起我的好友 Packy McCormick 关于垂直整合者的论述。用他的话来说,这些公司有几个决定性特征:
垂直整合企业是指那些:
- 整合多项前沿且经过验证的技术。
- 在其技术栈中发展重要的内部能力。
- 模块化标准化组件,同时掌控整体系统集成。
- 直接与现有行业巨头竞争。
- 提供更优质、更快速或更经济的产品(通常三者兼具)。
对于垂直整合者而言,整合本身就是创新。
和以往一样,这一策略面临明显挑战。天下没有免费的午餐!
一个巨大的障碍很可能是融资和资本形成。这种公司创建方式与大多数生物技术投资者考虑产生回报的方式完全不同。目前完全不清楚大型制药公司是否愿意在没有明确商业可行性证明的情况下收购拥有如此复杂产品的公司。
该领域的赢家可能需要另寻资金来源。一个可行的选择是利用日益壮大的"深度科技"风险资本池,这类资本专注于支持硬件领域的突破性进展和原子世界的创新。后期投资可能来自综合性成长型股权公司,而非传统的生物科技跨界基金。
在生物技术领域尝试打造垂直整合者,绝非胆小者所能胜任。
以新方式融合多种技术实属不易。融资将充满挑战。扩大商业化努力同样艰难。成功可能需要远比预期更长的时间。
鉴于所有这些因素,生物技术投资可能开始反映私募市场的整体演变趋势。企业可能会延长私有化状态的时间。以 SpaceX 为例,这家公司在私有化的 23 年间筹集了近 100 亿美元资金,目前估值已达 3500 亿美元。早期投资者和员工的流动性主要来自二级市场,而非并购交易或首次公开募股。
尽管困难重重,潜在的回报却是巨大的。
曾经难以想象的测量工具如今在生物学领域已司空见惯。催生上一代生物技术浪潮的基础洞见已被精炼并商品化。人工智能正在加速生物学向预测性和定量学科的转变。
解决癌症、传染病和大脑健康等以往方法难以应对的重大问题,可能需要整合多种数字与物理构建模块的创新解决方案。
如果这些解决全球问题的公司以新方式建立护城河,我们可能会见证首批市值超过 1 万亿美元的生物技术企业诞生。
当前公开生物技术市场的形势相当黯淡。对于美国生物技术公司而言,中国收购活动的持续升温进一步威胁了它们的成功前景。正如 Adam Feuerstein 所写:“市场情绪糟糕透顶,悲观氛围挥之不去,以至于人们开始严肃质疑这个行业是否还有翻身的可能。”
与此同时,早期市场充满潜力。技术创新的步伐同样迅猛。那些汲取了宝贵经验并掌握强大工具的创业者们,正在追求全新的理念。
或许正确的问题不是市场是否会反弹。因为它终将反弹。市场是周期性的。相反,问题在于生物技术是否正处于向全新阶段转变的边缘。如果是这样,那么现在正是创业的最佳时机。
换句话说……
生物科技已死。生物科技万岁!